总局2016年03月01日发布《保健食品注册与备案管理办法》该办法将保健食品产品上市的管理模式由原来的单一注册制调整为注册与备案相结合的管理模式。根据《保健食品注册与备案管理办法》,保健食品进行注册是需要提交安全性和保健功能评价材料,包括目录外原料及产品的安全性、保健功能试验评价材料,人群食用评价材料;功效成分或者标志性成分、卫生学、稳定性、菌种鉴定、菌种毒力等试验报告,以及涉及兴奋剂、违禁药物成分等检测报告。

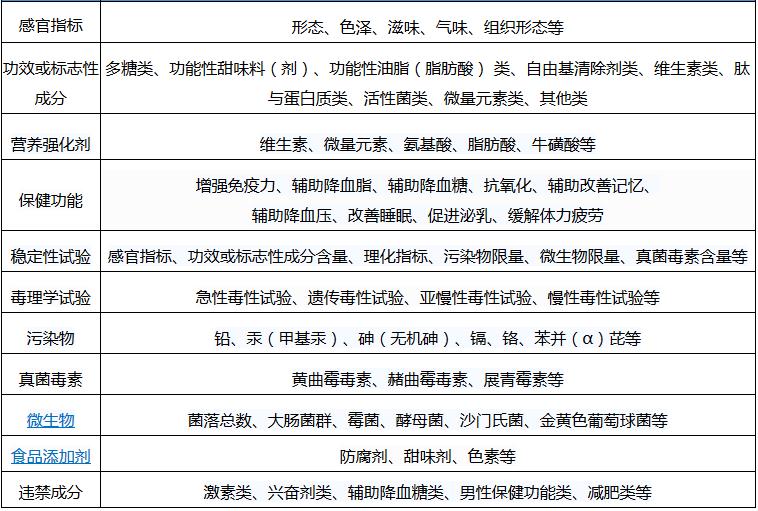
《保健食品检验与评价技术规范》

注册管理
对使用保健食品原料目录以外原料的保健食品和首次进口的保健食品(不属于补充维生素、矿物质等营养物质实行注册管理。
对使用的原料已经列入保健食品原料目录的和首次进口的属于补充维生素、矿物质等营养物质的保健食品实行备案管理。首次进口属于补充维生素、矿物质等营养物质的保健食品,其营养物质应当是列入保健食品原料目录的物质。
产品声称的保健功能应当已经列入保健食品功能目录。保健食品原料目录和允许保健食品声称的保健功能目录由总局会同国务院卫生行政部门、国家中医药管理部门制定、调整和公布,相关配套管理办法另行制定。
保健食品备案人资质
(一)国产保健食品的备案人应当是保健食品生产企业,原注册人可以作为备案人。
(二)进口保健食品的备案人,应当是上市保健食品境外生产厂商。
申请人资质
国产保健食品注册申请人应当是在中国境内登记的法人或者其他组织;进口保健食品注册申请人应当是上市保健食品的境外生产厂商。申请进口保健食品注册的,应当由其常驻中国代表机构或者由其委托中国境内的代理机构办理。
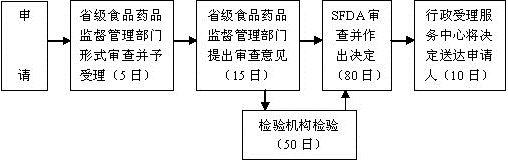
注册流程